Was ist Lungenfibrose? Eine Krankheit, die das Atmen immer schwerer macht
Lungenfibrose bezeichnet eine chronische Erkrankung der Lunge, bei der sich das Lungengewebe zunehmend vernarbt und verhärtet. Diese Vernarbung entsteht durch eine übermäßige Bildung von Bindegewebe in der Lunge, sogenannte Fibrosierung. Im Verlauf werden die feinen Wände der Lungenbläschen durch Narbengewebe ersetzt. Dadurch verliert die Lunge an Elastizität und versteift; es wird schwieriger, beim Einatmen die Lunge zu dehnen. Infolgedessen kann weniger Sauerstoff ins Blut übertreten, weil der Gasaustausch gestört ist. Anders als bei Asthma oder COPD, wo vor allem das Ausatmen erschwert ist, bereitet bei der Lungenfibrose vor allem das Einatmen Probleme – Betroffene erleben oft einen plötzlichen Atemstopp beim Einatmen.
Einfach gesagt: Bei einer Lungenfibrose verwandelt sich funktionsfähiges Lungengewebe allmählich in Narbengewebe, das nicht mehr am Gasaustausch teilnehmen kann. Je mehr Narben sich bilden, desto weniger Luft kann aufgenommen werden. Lungenfibrose ist ein Sammelbegriff für über 200 verschiedene Erkrankungen, die zu einer solchen Vernarbung führen können. Leider ist die Erkrankung chronisch und nicht vollständig heilbar, weil sich das vernarbte Gewebe nicht zurückbilden kann. Eine frühzeitige Diagnose und Therapie können jedoch das Fortschreiten verlangsamen.
Solltest du oder ein Angehöriger von dieser Krankheit betroffen sein, dann findest du in diesem Artikel alles, was du über diese Krankheit wissen musst.
Warum wird die Lunge hart? Die Ursachen der Lungenfibrose im Überblick
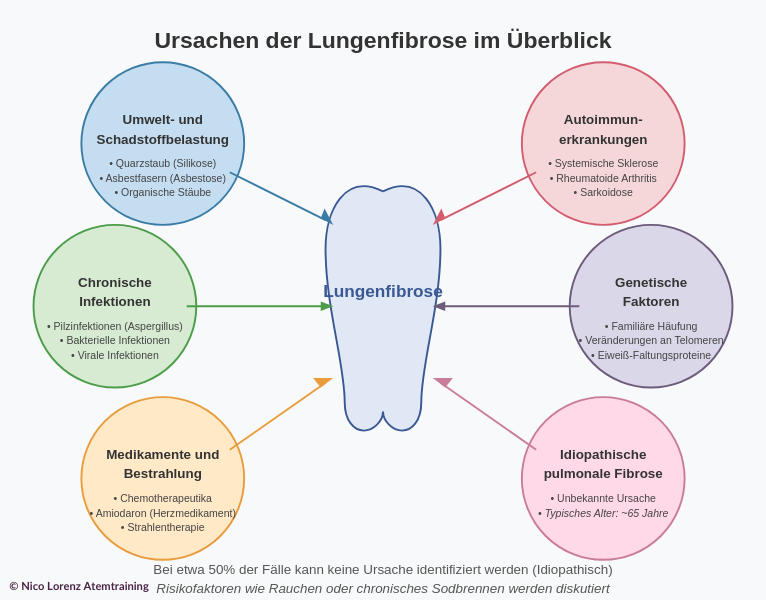
Die Ursachen der Lungenfibrose sind vielfältig. Bei etwa der Hälfte aller Betroffenen lässt sich eine konkrete Ursache finden, bei der anderen Hälfte bleibt sie unbekannt (idiopathisch). Im Folgenden sind die wichtigsten Ursachen und Auslöser zusammengefasst:
- Umwelt- und Schadstoffbelastung: Langjähriges Einatmen von Schadstoffen oder Reizstoffen kann das Lungengewebe schädigen. Beispielsweise können Quarzstaub (Silikose) oder Asbestfasern (Asbestose) eine Lungenfibrose auslösen. Diese Form tritt häufig als Berufskrankheit bei Bergleuten, Bauarbeitern oder Industriearbeitern auf, die jahrelang feinen Staubpartikeln ausgesetzt sind. Auch organische Stäube (Schimmelpilze, Vogelstaub) können über eine sogenannte exogen-allergische Alveolitis (auch „Farmerlunge“ oder „Vogelhalterlunge“) langfristig zu Fibrose führen, wenn der Kontakt mit dem Allergen andauert.
- Chronische Infektionen: Wiederkehrende oder langanhaltende Infektionen der Lunge können ebenfalls Vernarbungen begünstigen. Vor allem bestimmte Pilzinfektionen (z. B. Schimmelpilz Aspergillus) werden mit Lungenfibrose in Verbindung gebracht. Auch chronische bakterielle Infektionen (etwa Tuberkulose) oder virale Infektionen (etwa durch Grippeviren) können im Verlauf zu Narbenbildung im Lungengewebe führen.
- Medikamente und Bestrahlung: Als seltene Ursache kommen Arzneimittel-Nebenwirkungen in Betracht. Einige Medikamente – zum Beispiel bestimmte Chemotherapeutika (etwa Bleomycin) oder Amiodaron (ein Herzmedikament) – können als Nebenwirkung Lungengewebe schädigen und eine Fibrose verursachen. Auch Strahlentherapie im Brustbereich (z. B. zur Behandlung von Brustkrebs oder Lungenkrebs) kann das umliegende Lungengewebe vernarben lassen.
- Autoimmunerkrankungen: Manche rheumatische und autoimmune Krankheiten können die Lunge in Mitleidenschaft ziehen und eine Fibrose verursachen. Dazu zählen z. B. die Systemische Sklerose (Sklerodermie), bei der in rund der Hälfte der Fälle auch die Lunge vernarbt, oder die Rheumatoide Arthritis, bei der etwa 20 % der Patienten Lungenveränderungen entwickeln. Auch Sarkoidose, eine entzündliche Systemerkrankung, kann mit Lungenfibrose einhergehen.
- Genetische Faktoren: In seltenen Fällen tritt Lungenfibrose familiär gehäuft auf. Hier scheinen genetische Veränderungen eine Rolle zu spielen. Bei familiärer idiopathischer pulmonaler Fibrose wurden beispielsweise Veränderungen an Telomeren (Chromosomenenden) und bestimmten Eiweiß-Faltungsproteinen in Lungenzellen gefunden. Diese genetischen Faktoren führen zu einer vorzeitigen Alterung des Lungengewebes und begünstigen so die Krankheit.
- Idiopathische pulmonale Fibrose (IPF): Idiopathisch bedeutet, dass keine erkennbare Ursache vorliegt. Die idiopathische pulmonale Fibrose ist die häufigste Form der Lungenfibrose unklarer Ursache. Typischerweise sind Patienten mit IPF zum Diagnosezeitpunkt um die 65 Jahre alt. Warum es ohne Auslöser zu der fortschreitenden Vernarbung kommt, ist bislang nicht vollständig geklärt. Risikofaktoren wie Rauchen oder chronisches Sodbrennen könnten eine Rolle spielen, doch die genauen Mechanismen sind noch Gegenstand der Forschung. Wichtig zu wissen: Auch ohne erkennbare Ursache verläuft die IPF ähnlich wie andere Fibrosen – mit zunehmender Atemnot und Husten.
| Ursache | Geschätzter Anteil | Hauptauslöser | Besondere Merkmale |
| Idiopathische pulmonale Fibrose (IPF) | ~50% | Unbekannt | Typisches Erkrankungsalter ~65 Jahre; mögliche Risikofaktoren: Rauchen, chronisches Sodbrennen |
| Umwelt- und Schadstoffbelastung | ~15-20% | Quarzstaub, Asbestfasern, organische Stäube | Tritt häufig als Berufskrankheit auf; lange Latenzzeit zwischen Exposition und Erkrankung |
| Autoimmunerkrankungen | ~15% | Systemische Entzündungsreaktionen | Tritt als Komplikation bei bestehenden Grunderkrankungen auf |
| Chronische Infektionen | ~5-10% | Pilze, Bakterien, Viren | Oft nach langwierigen oder wiederkehrenden Lungeninfektionen |
| Medikamente und Bestrahlung | ~5% | Chemotherapeutika, Herzmedikamente, Strahlentherapie | Iatrogene (behandlungsbedingte) Ursache |
| Genetische Faktoren | ~3-5% | Veränderungen an Telomeren, Eiweiß-Faltungsproteinen | Familiäre Häufung, kann in jüngerem Alter auftreten |
Quelle: Lungeninfromationsdienst: https://www.lungeninformationsdienst.de/krankheiten/lungenfibrose
Erste Anzeichen erkennen: So macht sich eine Lungenfibrose bemerkbar
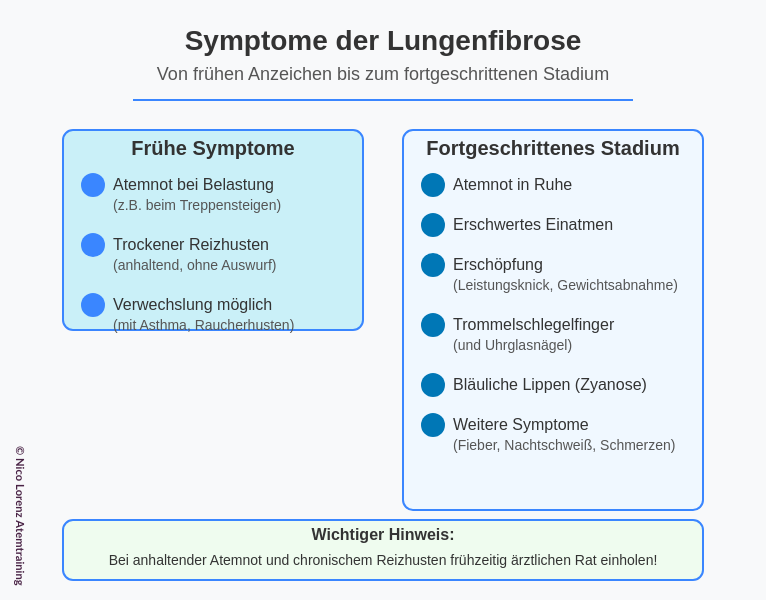
Eine Lungenfibrose entwickelt sich meist schleichend über Monate oder Jahre. Anfangs haben Betroffene oft keine oder nur milde Beschwerden. Frühe Symptome sind in der Regel:
- Atemnot bei Belastung: Zunächst bemerken viele eine zunehmende Kurzatmigkeit nur bei körperlicher Anstrengung – etwa beim Treppensteigen oder schnellen Gehen. Man gerät schneller „außer Atem“ als früher.
- Trockener Reizhusten: Ein anhaltender trockener Husten ohne Auswurf ist ein weiteres typisches Frühsymptom. Der Hustenreiz entsteht durch die Entzündung im Lungengewebe.
Diese Anzeichen werden anfangs leicht mit anderen Erkrankungen (wie Asthma oder Raucherhusten) verwechselt. Im fortgeschrittenen Krankheitsstadium jedoch treten deutlichere Symptome auf:
- Atemnot in Ruhe: Mit Fortschreiten der Vernarbung leiden Patienten auch in Ruhe oder bei minimaler Belastung unter Luftnot. Die Atmung wird flach und schnell (sog. „Hechelatmung“).
- Erschwertes Einatmen: Im Unterschied zu obstruktiven Lungenerkrankungen fällt bei Lungenfibrose vor allem das tiefe Einatmen schwer. Viele Betroffene haben das Gefühl, nicht genug Luft in die Lunge zu bekommen und müssen das Einatmen plötzlich abbrechen.
- Erschöpfung und Leistungsknick: Chronischer Sauerstoffmangel führt zu schneller Ermüdbarkeit, allgemeiner Schwäche, vermindertem Leistungsvermögen und oft auch Gewichtsabnahme. Alltägliche Aktivitäten fallen zunehmend schwer.
- Trommelschlegelfinger und Uhrglasnägel: In späteren Stadien verformen sich bei etwa der Hälfte der IPF-Patienten die Finger und Fingernägel. Die Endglieder der Finger verdicken sich keulenförmig (Trommelschlegelfinger), und die Nägel wölben sich wie ein Uhrglas. Dieses Phänomen hängt mit dem chronischen Sauerstoffmangel zusammen.
- Bläuliche Lippen (Zyanose): Durch die unzureichende Sauerstoffaufnahme können Lippen und Haut eine bläuliche Färbung annehmen.
- Weitere Symptome: Manche Patienten berichten über Fieber und Nachtschweiß in aktiven entzündlichen Phasen. Auch Muskel- und Gelenkschmerzen oder Brustschmerzen beim Atmen können auftreten, sind aber unspezifisch.
Wichtig: Die Symptome einer Lungenfibrose sind nicht eindeutig und ähneln denen anderer Lungenerkrankungen. Wer also unter zunehmender Atemnot und chronischem Reizhusten leidet, sollte frühzeitig einen Arzt aufsuchen. Je früher die Diagnose gestellt wird, desto eher kann eine Behandlung beginnen, die den Krankheitsverlauf verlangsamt.
Wie wird Lungenfibrose diagnostiziert?
Um eine Lungenfibrose zu diagnostizieren, wird der Arzt Schritt für Schritt verschiedene Untersuchungen durchführen. Zunächst steht die gründliche Anamnese (Erhebung der Krankengeschichte) im Vordergrund: Der Arzt wird fragen, welche Symptome bestehen, seit wann sie auftreten und ob Risikofaktoren vorliegen. Wichtig sind Informationen zum Beruf und Umwelt (gab es Schadstoff-Exposition wie Staub, Asbest?), zu Vorerkrankungen (z. B. Rheuma, Kollagenosen) und zu Medikamenten. Oft gibt erst eine solche Befragung den Hinweis auf eine mögliche Fibrose, da die frühen Symptome unspezifisch sind.
Danach folgen körperliche Untersuchungen. Beim Abhören der Lunge mit dem Stethoskop lässt sich häufig ein charakteristisches Geräusch feststellen: feine Knisterrasselgeräusche am Ende des Einatmens, ähnlich dem Geräusch von Klettverschluss. Dieses sogenannte Sklerosiphonie oder „Velcro-Geräusch“ entsteht durch das Auseinanderziehen der vernarbten Alveolen. Zudem achtet der Arzt auf schnelle Atmung oder Anzeichen von Sauerstoffmangel (etwa bläuliche Lippen).
| Untersuchung | Zweck / Was wird überprüft? | Besonderheiten |
| Anamnese (Krankengeschichte) | Risikofaktoren, Symptome, berufliche Exposition | Erster Hinweis auf mögliche Ursachen |
| Körperliche Untersuchung | Abhören der Lunge, Atemmuster, Sauerstoffsättigung | Typische „Knistern“-Geräusche beim Einatmen (Velcro-Sound) |
| Röntgen der Lunge | Überblick über Lungenstruktur, erste Anzeichen einer Fibrose | Nicht immer aussagekräftig, oft ergänzende Tests nötig |
| High-Resolution-CT (HR-CT) | Hochauflösende Bilder zur genauen Darstellung der Lungenveränderungen | Goldstandard zur Diagnose |
| Lungenfunktionstest (Spirometrie) | Messung von Lungenvolumen und Atemkapazität | Zeigt eine restriktive Ventilationsstörung |
| Diffusionskapazität (DLCO) | Überprüfung des Gasaustausches in der Lunge | Verminderter Wert zeigt beeinträchtigten Sauerstofftransport |
| Blutuntersuchung | Entzündungswerte, Autoimmunmarker, Sauerstoffgehalt im Blut | Hilft, andere Ursachen auszuschließen |
| Bronchoskopie mit Gewebeprobe (Biopsie) | Entnahme von Lungengewebe zur mikroskopischen Untersuchung | Nicht immer erforderlich, nur bei unklaren Fällen |
| 6-Minuten-Gehtest | Überprüfung der Belastbarkeit und Sauerstoffabfall unter Bewegung | Zeigt Einschränkungen der körperlichen Leistungsfähigkeit |
Die Diagnose Lungenfibrose wird letztlich aus dem Zusammenspiel von klinischem Bild, den Ergebnissen der Bildgebung und Lungenfunktion sowie – falls durchgeführt – der Biopsie gestellt. Oft bespricht ein Expertenteam aus Lungenärzten, Radiologen und Pathologen gemeinsam den Befund, um die Diagnose zu sichern und die bestmögliche Therapie einzuleiten.
Zwei Tests für Zuhause
6-Minuten-Gehtest (6MWT) – Belastungstest für die Lungenfunktion
Der 6-Minuten-Gehtest (6MWT) ist eine einfache, aber sehr aussagekräftige Methode, um die körperliche Leistungsfähigkeit und die Sauerstoffversorgung bei Patienten mit Lungenfibrose zu überprüfen. Ziel des Tests ist es, herauszufinden, wie weit eine Person innerhalb von sechs Minuten in einem ebenen Flur mit fester Länge gehen kann, ohne sich übermäßig zu verausgaben.
Wie läuft der 6-Minuten-Gehtest ab?
- Vorbereitung: Der Patient trägt bequeme Kleidung und geeignetes Schuhwerk. Falls notwendig, darf er eine Sauerstofftherapie während des Tests verwenden. Vor Testbeginn werden Puls, Blutdruck und Sauerstoffsättigung (per Pulsoximeter am Finger) gemessen.
- Durchführung: Der Patient wird angewiesen, in seinem eigenen Tempo so weit wie möglich geradeaus zu gehen – jedoch nicht zu rennen. Dabei darf er Pausen machen, wenn nötig. Die Strecke wird mit Markierungen angezeigt.
- Überwachung: Während des Tests wird regelmäßig der Sauerstoffgehalt im Blut überprüft. Sinkt die Sauerstoffsättigung unter 88 %, kann dies auf eine fortgeschrittene Lungenfibrose hinweisen. Auch die Atemfrequenz und das subjektive Luftnot-Empfinden (Borg-Skala) werden erfasst.
- Auswertung: Am Ende wird die zurückgelegte Distanz in Metern gemessen. Ein deutlicher Leistungsabfall oder ein Sauerstoffabfall während des Gehens sind Hinweise darauf, dass die Lungenfunktion eingeschränkt ist.
Was sagt das Ergebnis aus?
- Ein gesunder Erwachsener schafft im Durchschnitt etwa 400–700 Meter in sechs Minuten.
- Werte unter 350 Metern können auf eine erhöhte körperliche Einschränkung hindeuten.
- Ein starker Abfall der Sauerstoffsättigung (<88 %) während des Tests weist darauf hin, dass eine Sauerstofftherapie notwendig sein könnte.
- Der Test wird oft wiederholt, um den Krankheitsverlauf zu beobachten.
Sit-to-Stand-Test (STS) – Alternative zum Gehtest
Der Sit-to-Stand-Test (STS) ist eine kürzere, aber effektive Alternative zum 6-Minuten-Gehtest. Er wird oft eingesetzt, wenn der Patient nicht längere Strecken gehen kann oder der Platz für einen Gehtest nicht vorhanden ist.
Wie läuft der Sit-to-Stand-Test ab?
- Der Patient sitzt auf einem normalen Stuhl (ohne Armlehnen) mit einer Sitzhöhe von etwa 46 cm.
- Die Füße stehen flach auf dem Boden, die Arme sind über der Brust verschränkt.
- Auf ein Signal hin muss der Patient so oft wie möglich innerhalb von 30 oder 60 Sekunden aus dem Sitz aufstehen und sich wieder setzen.
- Die Anzahl der kompletten Stand-Sitz-Wiederholungen wird gezählt.
Was sagt das Ergebnis aus?
- Gesunde Erwachsene schaffen in 30 Sekunden meist >12 Wiederholungen, ältere Menschen oder Patienten mit Lungenfibrose oft deutlich weniger.
- Eine niedrige Wiederholungszahl deutet auf Muskelschwäche, eingeschränkte Belastbarkeit oder Atemnot hin.
- Wie beim Gehtest kann der Sauerstoffgehalt im Blut gemessen werden – ein Abfall unter 88 % zeigt eine relevante Einschränkung.
Welche Behandlungsmöglichkeiten gibt es?
Obwohl eine Lungenfibrose nicht heilbar ist, gibt es verschiedene Behandlungsansätze, um das Fortschreiten zu verlangsamen, Symptome zu lindern und die Lebensqualität zu verbessern. Die Therapie der Lungenfibrose richtet sich nach der Ursache (sofern bekannt) und dem Schweregrad der Erkrankung. Im Wesentlichen umfasst die Behandlung folgende Säulen:
Medikamentöse Therapie
Die medikamentöse Behandlung zielt darauf ab, Entzündungen zu hemmen und die Narbenbildung zu bremsen. Welche Medikamente eingesetzt werden, hängt von der Art der Fibrose ab:
- Kortison (Glukokortikoide): Bei vielen Formen der Lungenfibrose, die durch Entzündungen verursacht werden (z. B. exogen-allergische Alveolitis oder bei Autoimmunerkrankungen), sind Kortisonpräparate ein zentraler Bestandteil der Therapie. Kortison wirkt stark entzündungshemmend und kann die überschießende Immunreaktion dämpfen. In akuten Phasen oder bei Verschlechterungen („Schüben“) wird oft eine höhere Dosis gegeben, später versucht man die Dosis so gering wie möglich zu halten. Bei langfristiger Kortisontherapie kombiniert man häufig immunsuppressive Mittel (z. B. Azathioprin oder Methotrexat), um den Kortisonbedarf zu reduzieren.
- Antifibrotische Medikamente: Speziell für die idiopathische pulmonale Fibrose (IPF) wurden in den letzten Jahren zwei Medikamente zugelassen: Pirfenidon und Nintedanib. Diese Wirkstoffe können die Fibrose nicht rückgängig machen, aber sie verlangsamen die Vernarbung der Lunge. Studien zeigen, dass beide Medikamente das Fortschreiten der IPF über alle untersuchten Schweregrade hinweg gleich gut auf das Fortschreiten der Erkrankung auswirken. Sie kommen vorrangig bei IPF zum Einsatz und müssen dauerhaft eingenommen werden, sofern sie vertragen werden.
- Antibiotika (bei Infektionen): Liegt einer Verschlechterung der Lungenfunktion eine bakterielle Infektion zugrunde (zum Beispiel eine Lungenentzündung bei bestehender Fibrose), werden natürlich Antibiotika eingesetzt. Bei exazerbierten Fibrose-Schüben prüfen Ärzte immer, ob nicht eine versteckte Infektion der Auslöser ist, um diese gezielt zu behandeln. Antibiotika selbst behandeln nicht die Fibrose, sondern die Infektion, um weitere Schäden zu verhindern.
Wichtig ist: Die Wahl der Medikamente muss individuell angepasst werden. Bei einer Autoimmunerkrankung als Ursache wird man zum Beispiel eher Immunsuppressiva und Kortison kombinieren. Bei IPF ohne Entzündungskomponente stehen die antifibrotischen Medikamente im Vordergrund. Ihr Lungenarzt wird eine auf Sie zugeschnittene Therapie zusammenstellen.
Sauerstofftherapie
Viele Patienten mit fortgeschrittener Lungenfibrose haben chronischen Sauerstoffmangel (besonders bei Belastung, später auch in Ruhe). In solchen Fällen kann eine Sauerstoff-Langzeittherapie helfen. Dabei wird über eine Nasenbrille zusätzlich reiner Sauerstoff zugeführt – oft zunächst stundenweise, bei schweren Verläufen bis zu 16 Stunden am Tag. Die Sauerstoffgabe verbessert die Versorgung der Organe, erhöht die Belastbarkeit und lindert Symptome wie Atemnot. Moderne tragbare Sauerstoffgeräte (z. B. Flüssigsauerstoff-Tanks oder Konzentratoren) ermöglichen es, dass Betroffene trotz Sauerstoffgabe mobil bleiben. Die Langzeit-Sauerstofftherapie kann die Lebensqualität deutlich steigern und wird vom Arzt verordnet, wenn der Sauerstoffgehalt im Blut unter bestimmte Grenzwerte absinkt.
Lungentransplantation
In sehr weit fortgeschrittenen Stadien – wenn die Lungenfunktion stark eingeschränkt ist und andere Therapien nicht mehr greifen – bleibt als letzter Ausweg die Lungentransplantation. Dabei wird die kranke Lunge (oder bei Bedarf beide Lungenflügel) durch ein Spenderorgan ersetzt. Eine Lungentransplantation kann die Lebensqualität verbessern und zusätzliche Lebensjahre ermöglichen. Allerdings ist sie ein großer Eingriff und kommt nur für ausgewählte Patienten in Frage: Man muss in relativ guter körperlicher Verfassung und meist unter 65 Jahre alt sein. Zudem müssen Patienten lebenslang Medikamente zur Unterdrückung des Immunsystems einnehmen, um eine Abstoßung des Spenderorgans zu verhindern. Die Entscheidung zur Transplantation wird in spezialisierten Zentren getroffen. Bei geeigneten Kandidaten wird dieser Schritt erwogen, wenn die Lungenfibrose trotz aller Therapien weiter fortschreitet und das Leben bedroht.
Weitere Maßnahmen
- Pulmonale Rehabilitation: Ein spezielles Reha-Programm für Lungenpatienten („Lungensport“) kann helfen, trotz der Einschränkungen die körperliche Fitness zu verbessern. Durch Atemübungen, Gehtraining, Krafttraining und Schulungen lernen Betroffene, mit ihrer Erkrankung besser umzugehen. Die Reha verbessert Ausdauer, Muskelkraft und vermittelt Techniken zur Atemerleichterung.
- Behandlung der Grunderkrankung: Wenn die Fibrose Folge einer bekannten Ursache ist (z. B. einer Autoimmunerkrankung oder chronischen Allergie), muss natürlich auch diese Grundkrankheit bestmöglich behandelt werden. Dazu gehören z. B. Medikamente gegen Rheuma oder das strikte Meiden des auslösenden Allergens bzw. Schadstoffs.
- Impfungen: Da Patienten mit Lungenfibrose anfälliger für Infektionen sind, empfehlen Ärzte meist eine jährliche Grippeschutzimpfung und eine Pneumokokken-Impfung. Diese Impfungen können schwere Infekte verhindern, die die Lunge weiter schädigen würden.
- Palliativmedizin: In sehr schweren Fällen, in denen eine Heilung nicht möglich ist, können palliativmedizinische Maßnahmen sinnvoll sein. Diese konzentrieren sich darauf, die Lebensqualität zu erhalten und Symptome wie Atemnot, Schmerz oder Angst zu lindern – zum Beispiel durch atemerleichternde Positionen, Opiate gegen Luftnot oder psychosoziale Unterstützung.
Wie kann man mit Lungenfibrose noch aktiv sein? - Tipps
Die Diagnose Lungenfibrose bedeutet eine Umstellung im Alltag, aber es gibt viele Möglichkeiten, aktiv und selbstständig zu bleiben. Eine angepasste Lebensweise kann Beschwerden lindern und die Lebensqualität verbessern.
1. Schonung und Bewegung im richtigen Maß
Auch wenn Atemnot erschöpft, bleibt Bewegung wichtig. Leichte Aktivitäten wie Spaziergänge oder Atemgymnastik helfen, die Lunge zu kräftigen. Wichtig ist ein gutes Gleichgewicht: Überanstrengen Sie sich nicht, aber vermeiden Sie auch keine Bewegung.
2. Atemtechniken gezielt nutzen
Spezielle Atemübungen, wie die Lippenbremse oder Bauchatmung, erleichtern das Atmen und reduzieren Luftnot. Ein Physiotherapeut kann Ihnen Techniken zeigen, die Sie im Alltag anwenden können.
3. Ernährung: Kleine Mahlzeiten, große Wirkung
Eine ausgewogene Ernährung hält den Körper stark. Besonders eiweißreiche Nahrung unterstützt die Muskulatur. Kleine Mahlzeiten sind oft besser als große, da sie das Zwerchfell entlasten.
4. Wohnumfeld optimieren
Passen Sie Ihre Umgebung an: Sitzmöglichkeiten in der Küche oder ein Duschhocker erleichtern den Alltag. Entfernen Sie Staub und Schimmel, um Atemreizungen zu vermeiden.
5. Sauerstofftherapie im Alltag integrieren
Falls Sie Sauerstoff benötigen, planen Sie Aktivitäten so, dass Sie sich nicht überfordern. Tragbare Geräte ermöglichen mehr Bewegungsfreiheit.
6. Soziale Kontakte pflegen
Der Austausch mit Familie, Freunden oder in Selbsthilfegruppen kann emotional entlasten. Bei psychischer Belastung kann professionelle Hilfe unterstützen.
7. Schutz vor Infekten
Regelmäßiges Händewaschen, Impfungen und das Meiden von Menschenmengen während der Grippezeit schützen vor Infektionen, die für Lungenfibrose-Patienten gefährlich werden können.
Atemtherapie bei Lungenfibrose: Wie gezielte Übungen die Luftnot lindern
Atemtherapie (Atemphysiotherapie) ist ein wichtiger Bestandteil im Umgang mit Lungenfibrose. Dabei handelt es sich um physiotherapeutische Maßnahmen, die speziell die Atmung und Lungenfunktion verbessern sollen. Geschulte Atemtherapeutinnen oder Physiotherapeuten zeigen Patienten Übungen, mit denen die Atmung effizienter und schonender wird. Zum Beispiel lernt man, bewusst in den Bauch zu atmen (Zwerchfellatmung), um die Atemhilfsmuskulatur zu entlasten, oder Husten- und Sekrettechniken, um festsitzenden Schleim abzutransportieren. Ziel der Atemtherapie ist es, Atemnot zu verringern und die Selbständigkeit im Alltag zu fördern.
Viele dieser Techniken – etwa die erwähnte Lippenbremse, bei der die Lippen beim Ausatmen halb geschlossen werden – können akute Atemnot mildern und dem Betroffenen das Gefühl von Kontrolle über die Atmung zurückgeben. Atemtherapie kann sowohl in Einzelübungen mit dem Therapeuten als auch in Lungensportgruppen erlernt werden. Regelmäßiges Üben verbessert oft die Belastbarkeit erheblich.
Ein anderes wichtiges Thema bei fortgeschrittener Lungenfibrose ist die pulmonale Hypertonie (Lungenhochdruck). Damit ist ein erhöhter Blutdruck im Lungenkreislauf gemeint – eine häufige Folgekomplikation chronischer Lungenerkrankungen. Durch das vernarbte Gewebe und den Sauerstoffmangel werden die Blutgefäße in der Lunge enger, und das Herz muss kräftiger pumpen, um Blut durch die Lunge zu drücken. Vor allem die rechte Herzhälfte wird dadurch belastet und vergrößert sich allmählich. Schließlich kann eine Rechtsherzschwäche (Cor pulmonale) entstehen.
Anzeichen dafür können Wassereinlagerungen in den Beinen, starke Abgeschlagenheit und zunehmende Atemnot selbst in Ruhe sein. Pulmonale Hypertonie ist ein ernstes Problem, das die Prognose weiter verschlechtern kann. Daher überwacht der Arzt bei Lungenfibrose-Patienten regelmäßig die Herzfunktion (mit Ultraschall des Herzens/Echokardiografie) und die Blutdruckwerte im Lungenkreislauf. In einigen Fällen kommen spezifische Medikamente zum Einsatz, die die Lungendurchblutung verbessern (sogenannte pulmonale Vasodilatatoren). Wichtig bleibt jedoch, die Grundkrankheit Lungenfibrose so gut wie möglich zu behandeln, um die Entstehung von Lungenhochdruck hinauszuzögern.
Was bedeutet die Diagnose für die Zukunft?
Der Verlauf einer Lungenfibrose kann sehr unterschiedlich sein und reicht von langsam fortschreitend bis hin zu rasch verschlechternd. Generell gilt: Je früher die Krankheit erkannt und behandelt wird, desto besser sind die Aussichten, das Fortschreiten zu bremsen. Eine Lungenfibrose lässt sich jedoch nicht rückgängig machen, da einmal vernarbtes Lungengewebe dauerhaft funktionslos bleibt. Die Prognose hängt von vielen Faktoren ab, unter anderem vom Ausmaß der Lungenschädigung, vom Tempo des Krankheitsfortschritts und davon, wie gut auf die Therapie angesprochen wird. Komplikationen wie Infektionen oder die bereits erwähnte pulmonale Hypertonie können den Verlauf zusätzlich verschlechtern.
Leider ist die Lungenfibrose eine ernste Erkrankung, die unbehandelt oft innerhalb weniger Jahre zum Tod führen kann. Besonders die idiopathische pulmonale Fibrose (IPF) hat einen aggressiven Verlauf: Ohne wirksame Therapie liegt die 5-Jahres-Überlebensrate nur bei etwa 20 bis 40 Prozent. Das heißt, fünf Jahre nach Diagnosestellung lebt nur noch circa ein Drittel der IPF-Patienten. Moderne Medikamente (Pirfenidon, Nintedanib) haben diese Prognose in den letzten Jahren etwas verbessert, doch die IPF bleibt leider meist fortschreitend. Bei anderen, sekundären Fibrosen kann die Prognose günstiger sein – zum Beispiel, wenn die auslösende Ursache gefunden und beseitigt wird. Wird etwa eine allergische Alveolitis früh erkannt und der Patient meidet konsequent das Allergen, kann sich der Zustand stabilisieren oder sogar leicht bessern. Auch bei bestimmten Autoimmun-Fibrosen hängt viel davon ab, wie gut die Grunderkrankung kontrolliert werden kann.
Wichtig zu wissen: Jede Lungenfibrose verläuft individuell. Manche Patienten können mit medikamentöser Therapie und Anpassung des Lebensstils viele Jahre relativ stabil leben. Bei anderen schreitet die Krankheit trotz allem schnell voran. Ärzte raten Betroffenen, die Erkrankung ernst zu nehmen, aber nicht die Hoffnung zu verlieren. Durch eine konsequente Behandlung und aktive Mitarbeit (z. B. bei Reha-Maßnahmen, Rauchstopp, etc.) lässt sich oft mehr Lebenszeit und -qualität gewinnen, als es die Statistik vermuten lässt.Zusammenfassend ist die Lungenfibrose zwar nicht heilbar, aber behandelbar. Die medizinische Forschung macht Fortschritte, und neue Therapien geben Anlass zur Hoffnung. Als Patient ist es wichtig, sich gut über die Erkrankung zu informieren, eng mit den Ärzten zusammenzuarbeiten und den eigenen Alltag bestmöglich an die gesundheitliche Situation anzupassen. So können Betroffene trotz der Herausforderung Lungenfibrose ein lebenswertes Leben führen.